-
Die Universität
- Herzlich willkommen
- Das sind wir
- Medien & PR
-
Studium
- Allgemein
- Studienangebot
- Campusleben
-
Forschung
- Profil
- Infrastruktur
- Kooperationen
- Services
-
Karriere
- Arbeitgeberin Med Uni Graz
- Potenziale
- Arbeitsumfeld
- Offene Stellen
-
Diagnostik
- Patient*innen
- Zuweiser*innen
-
Gesundheitsthemen
- Gesundheitsinfrastruktur
Alternative Biomodels and Preclinical Imaging
Unsere Ziele sind die Etablierung und Verwendung adäquater humaner und tierischer Zellkulturmodelle sowie die Einbindung präklinischer Bildgebung in laufende Projekte. Dies ermöglicht einerseits die Entwicklung von Methoden um die Tierzahl im Versuch zu reduzieren während gleichzeitig der Informationsgewinn gesteigert wird.
Präklinische Bildgebung
In vivo bedeutet wörtlich „innerhalb der Lebenden“. In vivo Bildgebungstechniken ermöglichen es uns, natürliche Prozesse und Krankheiten bei lebenden Tieren nicht-invasiv zu beobachten und sie über einen längeren Zeitraum hinweg zu überwachen. So können wir, unter Verwendung modernster Techniken, Bilder in verschiedensten Ebenen darstellen, vom Ganzkörperbild bis hin zu subzellulären Strukturen. Hierfür stehen folgende Verfahren zur Verfügung:
- mikroUltraschall: Sichtbar gemacht werden verschiedenste physiologische oder anatomische Strukturen durch hochfrequente Schallwellen als hochauflösendes 2D oder 3D Bild
- mikroComputertomographie: Sichtbar gemacht wird die unterschiedliche Durchlässigkeit der Röntgenstrahlung von Geweben und Materiealien. Die Darstellung erfolgt in 3 Ebenen
- Optische Bildgebung basierend auf Fluoreszenz und/oder Biolumineszenz: Bei Nutzung von Fluoreszenzsignalen werden Moleküle detektiert, die das Licht einer bestimmten Wellenlänge absorbieren und einer anderen Wellenlänge emittieren. Bei der sensitiveren Biolumineszenz wird ein Substrat (Luciferin) im Tier metabolisiert (Enzym Luciferase), wobei Licht emittiert und detektiert wird.
Außerdem betreut die CF ABPCI den Biological Irradiator RS2000 (RadSource) sowie zwei S2- Arbeitsbereiche.
Die Systeme der CF ABPCI können für verschiedene Fragestellungen verwendet werden (siehe Applikationen sowie technische Details bei den jeweiligen Systemen). Das Team der CF ABPCI steht Ihnen gerne für individuelle Fragen zur Projektplanung und Projektdurchführung zur Verfügung.
An der Karl-Franzens-Universität Graz ist außerdem ein präklinischer Magnetresonanztomograph verfügbar.
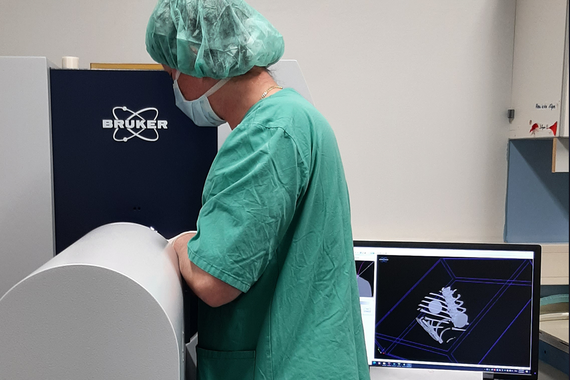
mikro-CT
Bruker´s SkyScan 1276 High Resolution in vivo X-Ray Microtomograph
Die mikro-Computertomographie ist ein nicht-invasives radiologisches Schnittbildverfahren mit sehr hoher Auflösung und kann sowohl für pathologische und physiologische Analysen als auch für Materialuntersuchungen verwendet werden.
Für in vivo Untersuchungen von Kleinnagern steht eine ins Gerät führende Anästhesieeinheit zur Verfügung. Mittlerweile ist dank gut entwickelter Kontrastmittel nicht mehr nur die Darstellung von Knochen, sondern auch die Untersuchung von Weichteilen möglich.
Eine Hochleistungs-Workstation (Dual Xeon mit 128 GB Arbeitsspeicher) zur Datenauswertung und Datennachbearbeitung in 2D und 3D mittels der Softwares Materialise MIMICS 22.0. und CTAn (Bruker)steht zur Verfügung.
Um ein zufriedenstellendes Ergebnis liefern zu können ist ein klärendes Gespräch zu Beginn unumgänglich. Hierbei werden die konkrete Fragestellung des Projekts, die Analysemöglichkeiten sowie der geschätzte Zeit- und Kostenaufwand geklärt. Unser Team wird dementsprechend die Untersuchungen und Auswertungen etablieren und durchführen.
Anwendungen:
- Quantifizierung von adipösem Gewebe
- Untersuchungen der Lunge
- Weichgebesuntersuchungen mit Kontrastmittel
- Knochenstrukturanalysen, Dichtemessungen und Implantatsuntersuchungen
- Materialuntersuchungen
Gerätespezifikationen
in vivo, ex vivo, in vitro
- cooled CCD X-Ray Detektor
- Detektorpixels 4032x 2688
- max. FOV 80 x 300 mm
- 20-100 kV
- 2.8 μm kleinster Pixel (ex vivo)
- 5-6 μm Details mit mehr als 10% Kontrast
mikroUltraschall
FUJIFILM VisualSonics‘ Vevo 3100
Das bedienerfreundliche Vevo 3100 ist das weltweit erste auf Touchscreen-Bedienung basierende präklinische Ultraschallsystem und steht in Österreich derzeit nur bei der CF ABPCI zur Verfügung. Alle vier Schallköpfe des Systems können an verschiedenen Organismen in allen verfügbaren Modi verwendet werden.
Anwendungsbeispiele:
- Onkologische Studien
- Bildgeführte Injektion
- Kardiovaskuläre Blutflussbeurteilungen
- Leberstudien
- Organscreening
Gerätespezifikationen:
- Auflösung bis zu 30µm
- Eindringtiefe bis zu 30 mm lt. SOP_Bedienung des Ultraschallsystems Vevo3100
- Vevo LAB Software
- VevoStrain Software Paket
- VevoVasc Software Paket
- nicht-invasive Untersuchungen in Echtzeit
- genauste Herz-Kreislauf Beurteilungen
- physiologische Überwachungseinheit
Optical Imaging
Spectral Instruments Imaging/ Oncomed Solutions´ Lago
Das Optical Imaging (optische Bildgebung) ist ein nicht-invasives, bildgebendes Verfahren, bei dem pathologische und physiologische Analysen, wie auch in vitro Versuche durchgeführt werden können. Für in vivo Untersuchungen von Kleinnagern steht eine ins Gerät führende Anästhesieeinheit sowie eine beheizte, lichtdichte Bildgebungskammer zur Verfügung.
Anwendungsbeispiele:
- Onkologische Studien
- Metabolische Studien
- Infektionsstudien
- Orthopädische Studien
Gerätespezifikationen:
- Messung von Fluoreszenz und Biolumineszenz
- Kapazität für eine zeitgleiche Messung von 5 oder 10 Tieren
- Anregungs-LEDs in 14 Wellenlängen (360nm - 805nm, auch Near-Infrared Bereich!)
- 20 Emissionsfilter (490nm – 870nm)
- Möglichkeit zur Serienaufnahme
- Aura Imaging Software

CellBank
Die CellBank bietet eine breite Palette an Dienstleistungen und kompetente technische Unterstützung für Zell- und Gewebekulturen an.
Die ISO-Zertifizierung der Core Facility gewährleistet eine umfassende Qualitätskontrolle der Zelllinien und ein kontrolliertes standardisiertes Lagersystem. Etablierungen und Charakterisierungen von Zelllinien erfolgen in enger Zusammenarbeit mit dem Universitären Comprehensive Cancer Center der Medizinischen Universität Graz.
Zelllinien der Med Uni Graz
In vitro Experimente in unterschiedlichen Zellsystemen können Tierversuche reduzieren und ersetzen. In jedem Fall bilden in vitro Versuche die Grundlage für Tierversuche im Sinne des 3R Prinzips. Die CellBank Graz stellt Forschenden der Medizinischen Universität Graz humane und tierische Zelllinien zur Verfügung, die einem hohen Qualitätsstandard entsprechen.
Die Liste aller zur Verfügung stehende Zelllinien für Forschende der Med Uni Graz wird auf Anfrage bereitgestellt.
Zelllinien werden auch auf Bedarf etabliert und eingehend charakterisiert.
Nicht-tumorigene Zelllinien:
humane, juvenile Fibroblasten
humane, adulte, dermale Fibroblasten
humane, juvenile Keratinozyten
MUG Lucifer iHDF, immortalisierte humane, dermale Fibroblasten
humane, juvenile Melanozyten
humane, adulte, dermale Melanozyten
Chordom Zelllinien:
Melanom Zelllinien:
Sarkom Zelllinien:
MUG CiDus: humanes Cix Dux 4 Sarkom
MUG EMCS: humanes extraskeletales, mesenchymales Chondrosarkom
MUG Lucifer Metastase: humanes Klarzellsarkom Lungenmetastase
Cholangio-Karzinom Zelllinien:
MUG CCArly 1: humanes Cholangiokarzinom/Klatskintumor
Qualitätsstandards
Mykoplasmendetektion: Die Core Facility bietet eine der sensitivsten Methoden, die Polymerasekettenreaktion (PCR), für die regelmäßige Qualitätskontrolle der Zellkulturen an.
Identifizierung von humanen Zelllinien: Short Tandem Repeat (STR) Analysen mittels PowerPlex® 16 System werden für die Authentifizierung von humanen Zelllinien verwendet. Das Service beinhaltet die Analyse, und/oder Extraktion der genomischen DNA, sowie den Abgleich des DNA-Profils mit Zelldatenbanken.
Cell Culture Facility
Die Cell Culture Facility, die sich mit dem humanen Teil im ZMF und der humanen/tierischen Zellkultur im BMF befindet, unterstützt die Forschung durch die Bereitstellung von Zelllinen, sowie durch Bereitstellung von z.B. Medien, Verbrauchsmaterialien und Fachwissen. Die Einrichtung stellt 3D Spheroid Kulturen, sowie Co-Kultur Systeme für Forschende zur Verfügung und bietet Zellkulturbasierende Assays, wie z.B. Proliferationsassays, Viabilitätsassays, Migrations- und Invasionsassays an. Die Cell Culture Facility ermöglicht auch die Nutzung einer Zytostatika-Werkbank und der vorhandenen Infrastruktur. Unsere Ausstattung umfasst:
- S2 Labor ZMF
- Zytostatika S2 Labor ZMF
- S2 Labor BMF
- Photometer Clariostar
- xCELLigence Real Time System
- ExoView R200
FBS freie Zellkultur - humanes Plättchenlysat (hPl)
Tierfreie Zellkulturmodelle sind für die translationale Forschung und die klinische Anwendung von Zellkulturprodukten zwingend erforderlich. Mit der Verwendung des humanen Plättchenlysats (hPl) ist man in der Lage, das bisher verwendete fötale Kälberserum (FBS: fetal bovine serum) in verschiedenen Forschungsbereichen, vor allem für die Expansion mesenchymaler Stromazellen und in anderen Bereichen der regenerativen Medizin, zu ersetzen. Die Abteilung für Blutgruppenserologie und Transfusionsmedizin bietet für die Forschung ein gepooltes, humanes Plättchenlysat an. Dieses wird aus frischem Thrombozytenkonzentrat in ISO 9001:2015 zertifizierten Laboratorien hergestellt. Das humane Plättchenlysat "O Thrombozyten in AB-Plasma" ist hoch standardisiert und die Aliquots werden mit einem umfangreichen Qualitätszertifikat geliefert. Auf besonderen Wunsch ist ein GMP-grade O/AB hPl ebenfalls erhältlich.
Kontakt: Priv.Doz.in Mag.a Dr.in Claudia Maria Bernecker
Isolierung und Etablierung von extrazellulären Vesikel
Extrazelluläre Vesikel (EVs) sind Nanometer große Partikel (30nm bis 1000nm) die von Zellen abgegeben werden können und selbst nicht mehr vermehrungsfähig sind. Diese Partikel haben als großes Charakteristikum eine Lipid-Doppelmembran und dienen als Transporter für diverse Biomoleküle. Diese Biomoleküle dienen der Kommunikation, weshalb sie in der medizinischen Forschung eine immer wichtigere Rolle spielen. Sie sollen in Zukunft nicht nur als Biomarker für unterschiedlichste Krankheiten verwendet werden, sondern auch für die Therapie von Erkrankungen eingesetzt werden, indem sie Wirkstoffe verpacken und zu spezifische Zielzellen transportieren.
Die CF ABPCI hat sich auf Protokolle für die Isolierung und Charakterisierung von extrazellulären Vesikeln aus Zellkulturüberständen spezialisiert.
Isolierung von EVs
EVs können in so gut wie allen Körperflüssigkeiten nachgewiesen werden. Die CF ABPCI hat sich auf die Isolierung von EVs aus Blutplasma und auch Zellkulturüberständen spezialisiert. Je nach Anwendungsgebiet kann zwischen Ultrazentrifugation (UZ) und Size Exclusion Chromatographie (SEC) gewählt werden.
Von der Internationalen Society für EVs wurde 2018 eine Empfehlung herausgegeben, wie EVs isoliert und charakterisiert werden sollten um reproduzierbare und verlässliche Daten garantieren zu können. Zur Etablierung der Protokolle und bei der Planung von Versuchen wird von der CF ABPCI stets darauf geachtet diese Empfehlungen in die Arbeit einfließen zu lassen. Link zur Empfehlung
Ultrazentrifugation (UZ)
Size Exclusion Chromatography (SEC)
SEC erfreut sich einer immer größeren Beliebtheit in der Community, da diese Methode neben einer großen Ausbeute auch sehr native EVs verspricht. Außerdem läuft die Isolierung relativ rasch ab und könnte in weiteren Schritten auch automatisiert werden.
Zurzeit werden EVs aus PFP (=platelete free plasma) mit Sepharose SEC-Säulen isoliert, die zuvor mit PEG (=Polyethylenglycol) gefällt werden können.
Flow Assisted Cell Sorting (FACS)
Die FACS ist neben der Elektronenmikroskopie die vermutlich wichtigste Methode für die Erforschung von EVs. Großer Vorteil ist hier, dass einzelne EVs der Reihe nach auf gleich mehrere Marker untersucht werden können. Aufgrund der geringen Größe der Partikel sind jedoch hier ganz spezielle Methoden und Einstellungen zu verwenden, die sich stark von „normalen“ FACS Messungen unterscheiden.
Nano Tracking Analysis (NTA)
NTA wird verwendet um die Größenverteilung (30nm bis 1000nm) und Partikelkonzentration von EVs in Proben abschätzen zu können. Dabei werden die Partikel von einem Laser angeregt. Deren Brownsche Teilchenbewegung wird dann von einem Mikroskop gefilmt. Dieses Bildmaterial wird von einer Software ausgewertet und die Größe sowie die Konzentration der gemessenen Partikel berechnet.
Western Blot (WB)
WB wird vor allem für die Charakterisierung der isolierten EVs verwendet. Als Reinheitskriterium gelten Tetraspanin-Marker (CD9, CD63 und CD81), die es nachzuweisen gilt. Je nach verwendetem Biomaterial gibt es negative Marker, die idealerweise nicht oder kaum in den Proben nachgewiesen werden können. Im Falle von Blut sind das Marker (z.B. Apolipoprotein A1) für Lipoproteinpartikel, die EV Proben oft verunreinigen.
3D Zellkulturen und Co-Kulturen
Die Kultivierung von Zellen in einer mikrostrukturierten dreidimensionalen Zellkultur mit unterschiedlichen Zelltypen spiegelt die in vivo Situation wieder und ist optimal für die Testung von Chemotherapeutika.
Die CF ABPCI bietet 3D Tumormodelle in unterschiedlichen Matrices und Scaffolds sowie Einbettung und Färbeprotokolle an.


